Κάνναβη Και Επιληψία – Το CBD Στη Θεραπεία Της Επιληψίας: Μια Εστιασμένη Ανασκόπηση Των Αποδεικτικών Στοιχείων
Κάνναβη και Επιληψία – Το CBD στη θεραπεία της επιληψίας: μια εστιασμένη ανασκόπηση των αποδεικτικών στοιχείων και των κενών
Απόσπασμα Επιστημονικής Μελέτης : GD, Del Guerra FB, de Oliveira Lelis M and Pinto LF (2020) Cannabidiol in the Treatment of Epilepsy: A Focused Review of Evidence and Gaps.
Περίπου το ένα τρίτο των ασθενών με επιληψία συνεχίζει να ταλαιπωρείτε από επιληπτικές κρίσεις παρά τη χορήγηση αντισπασμωδικών φαρμάκων. Αυτό το κενό θεραπείας είναι που παρακινεί την έρευνα για νέες εναλλακτικές θεραπευτικές επιλογές, όπως η κανναβιδιόλη (CBD). Η CBD διαφέρει από άλλα παράγωγα κάνναβης λόγω της σταθερής αποτελεσματικότητάς της και της έλλειψης ψυχοδραστικής επίδρασης και μπορεί να συνιστάται ως συμπληρωματική θεραπεία σε ασθενείς με σύνδρομα Ντραβέ (Dravet) και Λένοξ-Γκαστό (Lennox-Gastaut). Οι πιο συχνές ανεπιθύμητες ενέργειες (ΑΕ) είναι η υπνηλία, η μειωμένη όρεξη, η διάρροια και ο έμετος. Η αύξηση των τρανσαμινασών είναι η πιο κοινή AE που οδηγεί σε διακοπή της CBD. Η συγχορήγηση με βαλπροϊκό μπορεί να αυξήσει τον κίνδυνο ηπατοτοξικότητας. Ο συνδυασμός CBD και κλοβαζάμης μπορεί να αυξήσει τόσο την αποτελεσματικότητα όσο και τον κίνδυνο των AE που σχετίζονται με αυτά τα φάρμακα. Τα κενά γνώσης που έχουμε έως τώρα εστιάζονται κυρίως στο ακριβές ποσοστό αποτελεσματικότητας, τη βέλτιστη δοσολογία της CBD για ενήλικες με εστιακή επιληψία, τη μακροπρόθεσμη ασφάλεια χρήσης της CBD και τις απαραίτητες βέλτιστες πρακτικές για τη βελτίωση της πρόσβασης στην κανναβιδιόλη για άτομα που ζουν με επιληψία.
Εισαγωγή
Η επιληψία μπορεί να είναι μια θεραπευτική πρόκληση. Παρά τον αυξανόμενο αριθμό των αντισπασμωδικών φαρμάκων (ASM), περίπου το ένα τρίτο των ασθενών με επιληψία εμφανίζουν επίμονες κρίσεις (1). Η χειρουργική θεραπεία, αν και ακόμη υποχρησιμοποιείται, μπορεί να είναι εναλλακτική σε έως και 25% αυτών των περιπτώσεων (2) και ως εκ τούτου πολλοί ασθενείς αναγκάζονται να ζουν με συνεχείς επιληπτικές κρίσεις. Αυτό το κενό θεραπείας παρακινεί την έρευνα για νέα αντισπασμωδικά φάρμακα, όπως η κανναβιδιόλη (CBD).
Η ιατρική χρήση της κάνναβης αποτελεί ένα από τα πλέον πολυσυζητημένα και αμφιλεγόμενα θέματα του Τύπου τις τελευταίες δύο δεκαετίες. Τρεις είναι οι λόγοι για αυτό (Α) η έκκληση να αποτελέσει μια «φυσική» εναλλακτική θεραπεία (3). (Β) Η ανακάλυψη ενός πολύπλοκου συστήματος κυτταρικής σηματοδότησης που ανταποκρίνεται στην κάνναβη, του ενδοκανναβινοειδούς συστήματος (4)· και (Γ) σημαντικές δημόσιες υποθέσεις, όπως η Charlotte Figi στις Ηνωμένες Πολιτείες (5).
Οι αρχικές ανασκοπήσεις του Cochrane και της Αμερικανικής Ακαδημίας Νευρολογίας διαπίστωσαν ότι δεν υπήρχαν επιστημονικά στοιχεία που να υποστηρίζουν τη χρήση κάνναβης για την επιληψία το 2014 (6, 7). Εκείνη την εποχή, υπήρχαν μόνο τέσσερις μελέτες σχετικά με τη χρήση κανναβινοειδών στην επιληψία (8–11). Όλες οι μελέτες έπασχαν από επιστημονική ανεπάρκεια και μεθοδολογικά προβλήματα, αλλά παρά το γεγονός αυτό, η χρήση της CBD για την αντιμετώπιση της επιληψίας συνέχισε να αυξάνεται (12).
Στο φυτό της κάνναβης διακρίνουμε μεταξύ άλλων δύο κύρια κανναβινοειδή την τετραϋδροκανναβινόλη (THC) και η κανναβιδιόλη (CBD) (3). Η THC είναι υπεύθυνη για τις ψυχοδραστικές και εφορικές επιδράσεις του φυτού, αλλά μελέτες σχετικά με τις επιπτώσεις της στην επιληψία έχουν δείξει αντικρουόμενα αποτελέσματα (13-16). Η THC συνδέεται με τους υποδοχείς κανναβινοειδών τύπου 1 (CB1) που υπάρχουν στα βασικά γάγγλια, την παρεγκεφαλίδα, τον ιππόκαμπο, τον υποθάλαμο και το μεταιχμιακό σύστημα. Η ανανδαμίδη και η 2-αραχιδονοϋλογλυκερόλη είναι ενδογενείς κανναβινοειδείς παράγοντες που δρουν στο προσυναπτικό CB1 και προκαλούν μείωση της διεγερτικής δραστηριότητας. Καθώς η THC είναι μερικός αγωνιστής, αυτό θα μπορούσε να εξηγήσει την προσπασμωδική δράση.
Το CBD είναι ένα κανναβινοειδές που δεν έχει ψυχοδραστικά αποτελέσματα. Έχει πιο σταθερή αντιεπιληπτική αποτελεσματικότητα από την THC (17, 18). Η CBD δεν ενεργοποιεί τους υποδοχείς κανναβινοειδών. Ωστόσο, αλληλεπιδρά με πολλά άλλα συστήματα σηματοδότησης. Η σηματοδότηση με τη μεσολάβηση βανιλλοειδούς τύπου 1 (TRPV1) με δυνατότητα παροδικού υποδοχέα μπορεί να είναι η πιο σχετική οδός στην αντισπασμωδική δράση της CBD (19–21).
Αποδεικτικά στοιχεία για την αποτελεσματικότητα
Το 2016, ο Δρ Orrin Devinsky παρουσίασε μια μελέτη με 214 φαρμακοανθεκτικούς ασθενείς με παιδική επιληψία που έλαβαν CBD. Τα σύνδρομα Dravet (20%) και Lennox-Gastaut (19%) ήταν οι πιο συχνές αιτίες. Η αρχική δόση των 5 mg/kg/ημέρα αυξήθηκε μέχρι τη μέγιστη δόση των 50 mg/kg/ημέρα σε όσους ασθενείς εάν ήταν ανεκτή. Η διάμεση μηνιαία συχνότητα των κινητικών κρίσεων ήταν 30,0 κατά την έναρξη και μειώθηκε σε 15,8 κατά τη διάρκεια της περιόδου θεραπείας 12 εβδομάδων (22).
Μια άλλη ανοιχτή μελέτη πραγματοποιήθηκε σε ασθενείς με φαρμακοανθεκτική επιληψία με φυματώδη σκλήρυνση που έλαβαν CBD. Η αρχική δόση των 5 mg/kg/ημέρα αυξήθηκε κατά 5 mg/kg/ημέρα κάθε εβδομάδα μέχρι τη μέγιστη δόση των 50 mg/kg/ημέρα εάν ήταν ανεκτή. Η διάμεση μείωση στη συνολική εβδομαδιαία συχνότητα κρίσεων ήταν 48,8% μετά από 3 μήνες θεραπείας (23).
Το 2017, δημοσιεύτηκε μελέτη που αξιολογούσε την CBD υψηλής καθαρότητας σε ασθενείς με σύνδρομο Dravet (24). Η ομάδα ελέγχου έλαβε ένα εξαιρετικά καθαρό διάλυμα CBD 100 mg/ml. Η δόση αυξήθηκε έως και 20 mg/kg. Το ποσοστό των ασθενών που είχαν τουλάχιστον 50% μείωση στη συχνότητα των σπασμών ήταν 43% μετά από μια περίοδο θεραπείας 14 εβδομάδων με CBD. Οι συνολικές συνθήκες ζωής βελτιώθηκαν κατά τουλάχιστον μία κατηγορία στην κλίμακα γενικής κλινικής εικόνας (CGCI – Caregiver Global Impression of Change) για το 62% των ασθενών στην ομάδα που λάμβανε CBD. Μάλιστα τρεις ασθενείς έπαψαν να έχουν επιληπτικές κρίσεις. Παρόλα αυτά δεν υπήρξε σημαντική μείωση των μη σπασμωδικών κρίσεων.
Το 2018, δημοσιεύθηκε) νέα μελέτη με ασθενείς με σύνδρομο Lennox-Gastaut που χρησιμοποιούσαν CBD (25). Οι ασθενείς είχαν δύο ή περισσότερες επιληπτικές κρίσεις την εβδομάδα και μέση ηλικία τα 16 έτη. Θετικότερα αποτελέσματα προέκυψαν για τις ομάδες 10 και 20 mg/kg CBD κατά τη διάρκεια της περιόδου θεραπείας με μια μέση ποσοστιαία μείωση από την αρχική τιμή στη συχνότητα των επιληπτικών κρίσεων 37,2% και 41,9% ενώ τα ποσοστά βελτίωσης της γενικής κλινικής εικόνας που παρατηρήθηκαν ήταν της τάξεως του 66% και 57% αντίστοιχα.
Μια άλλη δοκιμή φάσης 3 διερεύνησε την αποτελεσματικότητα της CBD ως συμπληρωματικής θεραπείας για επιληπτικές κρίσεις σε ασθενείς με σύνδρομο Lennox-Gastaut και ανθεκτικότητα στη θεραπεία. Τα αποτελέσματα επιβεβαίωσαν την αποτελεσματικότητα της CBD με μια μέση ποσοστιαία μείωση στη μηνιαία συχνότητα κρίσεων κατά 43,9% σε ασθενείς που έλαβαν θεραπεία με 20 mg/kg CBD σε σύγκριση με 21,8% στην ομάδα που έλαβε placebo (εικονικό φάρμακο). Άλλα δευτερεύοντα αποτελέσματα ήταν θετικά, συμπεριλαμβανομένου ενός μεγαλύτερου ποσοστού ασθενών που παρουσίασαν μείωση ≥75% επιληπτικών κρίσεων κατά τη διάρκεια της περιόδου θεραπείας (20% CBD έναντι 8% στο εικονικό φάρμακο, p = 0,0273) (26).
Μια συστηματική ανασκόπηση εντόπισε έξι επιπλέον μελέτες σε συνθήκες ελεγχόμενου περιβάλλοντος (27). Η μέση ηλικία των συμμετεχόντων ήταν 16,1 έτη (0,5–55 έτη). Σε δόση 20 mg/kg/ημέρα, ο αριθμός που χρειαζόταν για τη θεραπεία ενός ατόμου που παρουσίαζε 50%+ μείωση των κρίσεων ήταν 8. Η CBD ήταν πιο αποτελεσματική από το εικονικό φάρμακο στην επίτευξη πλήρους ελευθερίας κρίσεων. Σε 14 μελέτες παρατήρησης, το 8,5% των ασθενών ήταν χωρίς επιληπτικές κρίσεις (95% CI, 3,8–14,5%).
Μια άλλη πρόσφατη συστηματική ανασκόπηση (28) αξιολόγησε τον ρόλο της ταυτόχρονης χρήσης κλοβαζάμης (CLB) στην αποτελεσματικότητα της CBD σε ασθενείς με σύνδρομο Dravet και σύνδρομο Lennox-Gastaut και ενέγραψε 714 συμμετέχοντες σε τέσσερις δοκιμές (429 έλαβαν θεραπεία με CBD, 240 με ταυτόχρονη λήψη CLB ). Τα ποσοστά των ασθενών που έλαβαν μόνο CBD και όχι CLB και εμφάνισαν μείωση τουλάχιστον κατά 50% στη συχνότητα των κρίσεων κατά τη διάρκεια της περιόδου θεραπείας ανήλθαν σε 29,1%. Ανάμεσα στους ασθενείς που έλαβαν ταυτόχρονα και CLB, επιτεύχθηκε μείωση κατά 50% στη συχνότητα εμφάνισης κρίσεων στο 52,9%. Αυτή η μελέτη προτείνει ότι παρά τις αλληλεπιδράσεις που εμφανίζονται μεταξύ CBD και CLB, η συμπληρωματική θεραπεία με CBD μπορεί να μειώσει τις κρίσεις ανεξάρτητες από την ταυτόχρονη CLB, ενισχύοντας ότι η CBD έχει εγγενή αντισπασμωδική δράση (28).
Τα διαθέσιμα δεδομένα υποδεικνύουν ότι οι ασθενείς που λαμβάνουν συνθεραπεία με CBD και CLB έχουν υψηλότερα ποσοστά ανταπόκρισης, υπογραμμίζοντας ότι τόσο οι φαρμακοδυναμικές όσο και οι φαρμακοκινητικές αλληλεπιδράσεις μπορεί να συμβάλλουν στην αποτελεσματικότητα αυτού του συνδυασμού (29).
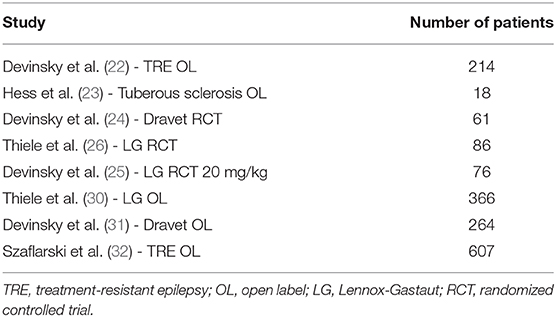
Ως εκ τούτου, η CBD είναι αποτελεσματική ως συμπληρωματική θεραπεία στην ανθεκτική στα φάρμακα παιδική επιληψία. Ωστόσο, τα τρέχοντα στοιχεία περιορίζονται σε σπάνια και σοβαρά επιληπτικά σύνδρομα. Μια περίληψη της αποτελεσματικότητας της CBD φαίνεται στον Πίνακα 1 και στο Σχήμα 1 (12).
Πίνακας 1. Σημαντικές μελέτες σχετικά με την CBD στη θεραπεία της επιληψίας
www.frontiersin.org
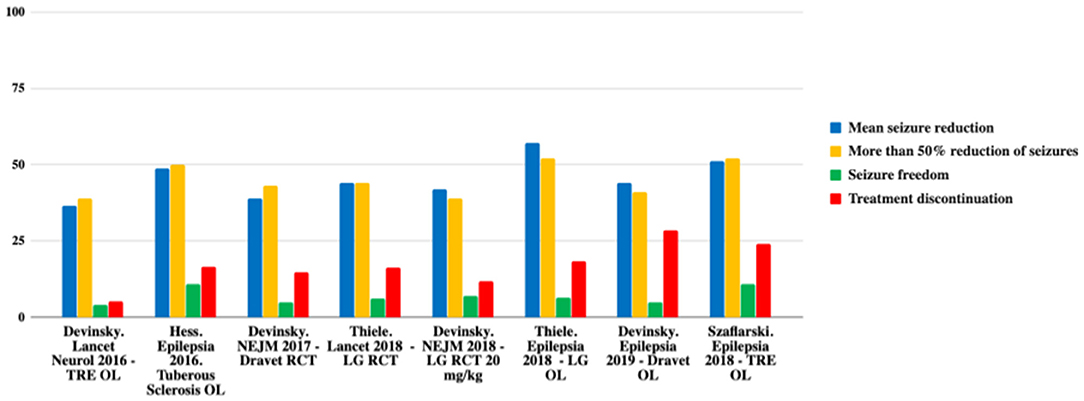
Σχήμα 1. Σύγκριση αποτελεσματικότητας στις κύριες μελέτες. TRE, επιληψία ανθεκτική στη θεραπεία. OL, ανοιχτή ετικέτα. LG, Lennox-Gastaut; RCT, τυχαιοποιημένη ελεγχόμενη δοκιμή. Προσαρμογή από (12).
www.frontiersin.org
Ασφάλεια
Δεν συνιστούμε την ινδική κάνναβη ή άλλες ενώσεις πλούσιες σε THC επειδή η επίδρασή τους στον έλεγχο των επιληπτικών κρίσεων είναι αβέβαιη και έχουν ψυχοτρόπα αποτελέσματα (12). Μπορεί να παρουσιάζουν κίνδυνο εξάρτησης, κατάθλιψης, ψύχωσης και απόπειρας αυτοκτονίας. Πράγματι, εκτιμάται ότι έως και το 50% της ψύχωσης του πρώτου επεισοδίου θα μπορούσε να προληφθεί με τον έλεγχο της έκθεσης στην κάνναβη σε ορισμένες χώρες (20, 33).
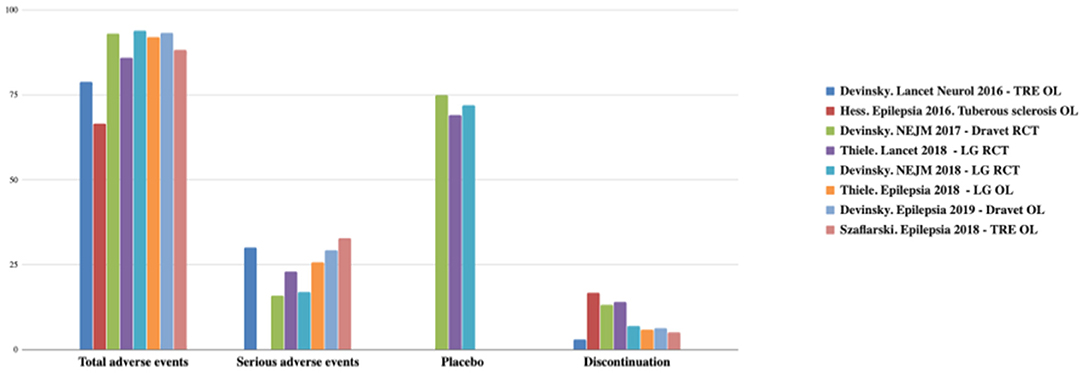
Το CBD έχει καλύτερο προφίλ ασφάλειας. Συνήθως, οι ανεπιθύμητες ενέργειες (ΑΕ) είναι ήπιες και παρατηρούνται μόνο τον πρώτο μήνα. Οι πιο συχνές ΑΕ είναι υπνηλία, μειωμένη όρεξη, διάρροια, έμετος, κόπωση και πυρετός. Το ποσοστό ασυνέχειας CBD είναι χαμηλό (3–13%) (22–26, 34). Οι ΑΕ συνοψίζονται στα Σχήματα 2, 3 (12).
Εικόνα 2. Συνολικές και σοβαρές ανεπιθύμητες ενέργειες και ποσοστά διακοπής που παρατηρήθηκαν με το CDB. TRE, επιληψία ανθεκτική στη θεραπεία. OL, ανοιχτή ετικέτα. LG, Lennox-Gastaut; RCT, τυχαιοποιημένη ελεγχόμενη δοκιμή. Προσαρμογή από (12).
www.frontiersin.org
Εικόνα 3. Οι πιο συχνές ανεπιθύμητες ενέργειες που παρατηρήθηκαν με το CBD. TRE, επιληψία ανθεκτική στη θεραπεία. OL, ανοιχτή ετικέτα. LG, Lennox-Gastaut; RCT, τυχαιοποιημένη ελεγχόμενη δοκιμή. Προσαρμογή από (12).
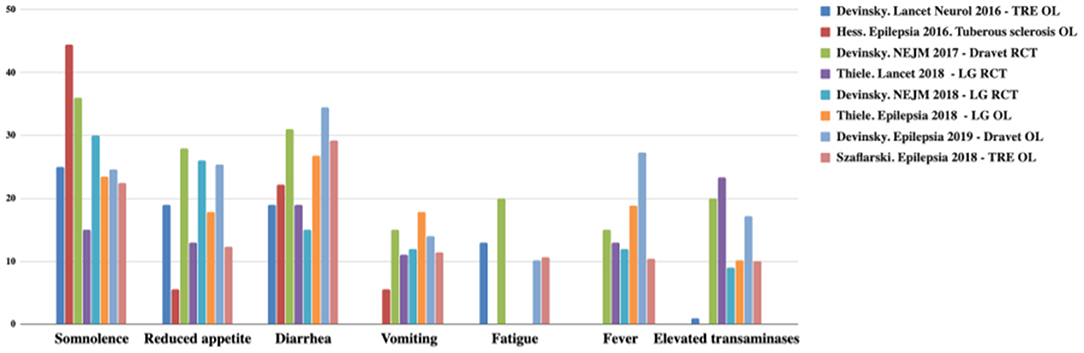
www.frontiersin.org
Η εργαστηριακή παρακολούθηση είναι σημαντική για τον έλεγχο της ηπατοτοξικότητας. Οι αυξημένες τρανσαμινάσες οδηγούν σε απόσυρση της CBD σε μια μειοψηφία ασθενών. Η ταυτόχρονη χρήση βαλπροϊκού είναι ένας παράγοντας κινδύνου για αυτήν την επιπλοκή. Οι τρανσαμινάσες συνήθως επιστρέφουν στην αρχική τιμή μετά τη μείωση ή την απόσυρση της δόσης CBD (24–26).
Φαρμακοκινητική και Φαρμακευτικές Αλληλεπιδράσεις
Καθώς η CBD έχει χρόνο ημιζωής που κυμαίνεται από 18 έως 32 ώρες, συνήθως χορηγείται σε δύο ισόποσες δόσεις ημερησίως. Η CBD είναι εξαιρετικά λιπόφιλη και, ως εκ τούτου, πωλείται σε κάψουλες ή εκχυλίσματα με βάση κάποιο λάδι. Οι ασθενείς που έλαβαν τροφή με υψηλή περιεκτικότητα σε λιπαρά παρουσίασαν 14 φορές υψηλότερη συγκέντρωση CBD από εκείνους σε κατάσταση νηστείας (35). Επομένως, συνιστούμε να λαμβάνεται το CBD μαζί με την τροφή για να μεγιστοποιηθεί η απορρόφηση.
Η CBD περιλαμβάνεται μεταξύ των ASM αναστολέων ενζύμου (36). Ως εκ τούτου, οι κλινικά σχετικές αλληλεπιδράσεις φαρμάκων της CBD με άλλα ASM προκαλούν ανησυχία. Η CBD είναι ένας ισχυρός αναστολέας των CYP3A4 και CYP2C19, οι οποίοι είναι υπεύθυνοι για το μεταβολισμό της CLB και της Ν-δεσμεθυλοκλοβαζάμης (N-CLB), αντίστοιχα (29). Ο συνδυασμός CBD-CLB έχει αποδειχθεί ότι αυξάνει τα επίπεδα CLB κατά μέσο όρο 60% (εύρος ± 80%) 4 εβδομάδες μετά την έναρξη. Ακόμη μεγαλύτερη αύξηση εμφανίζεται στη Ν-δεσμεθυλοκλοβαζάμη (έως 500%), έναν ενεργό μεταβολίτη (37). Αυτό μπορεί να αυξήσει τόσο την αποτελεσματικότητα όσο και τον κίνδυνο παρενεργειών για αυτόν τον συνδυασμό φαρμάκων.
Η συγχορήγηση CBD σχετίζεται επίσης με αύξηση των επιπέδων ζονισαμίδης, εσλικαρβαζεπίνης, τοπιραμάτης και ρουφιναμίδης (38). Δεν έχουν παρατηρηθεί αλληλεπιδράσεις με το βαλπροϊκό οξύ, τη στιριπεντόλη και τη λεβετιρακετάμη. Η φαινυτοΐνη και η καρβαμαζεπίνη πιθανότατα μειώνουν τα επίπεδα CBD (39). Ως εκ τούτου, η φαρμακευτική θεραπευτική παρακολούθηση άλλων ASMs μπορεί να είναι σημαντική όταν λαμβάνεται η CBD ως συμπληρωματική θεραπεία.
Κενά στη γνώση: Κανναβιδιόλη CBD για την επιληψία σε ενήλικες, μακροπρόθεσμη ασφάλεια και πρόσβαση
Οι ενήλικες ασθενείς με επιληψία υποεκπροσωπούνται στις περισσότερες δοκιμές CBD. Οι κοινές αιτιολογίες για την εστιακή επιληψία σε ενήλικες, όπως η επιληψία μετά το εγκεφαλικό επεισόδιο, η τραυματική εγκεφαλική βλάβη και η εστιακή δυσπλασία του φλοιού, δεν αναπαρίστανται σωστά σε αυτές τις δοκιμές.
Στα παιδιά η συνιστώμενη αρχική δόση είναι 2,5 mg/kg δύο φορές την ημέρα. Μετά από 1 εβδομάδα, η δόση μπορεί να αυξηθεί σε δόση συντήρησης 5 mg/kg δύο φορές την ημέρα (10 mg/kg/ημέρα). Η δόση θα μπορούσε να αυξηθεί εβδομαδιαίως κατά 2,5 mg/kg δύο φορές την ημέρα (5 mg/kg/ημέρα) έως τη μέγιστη συνιστώμενη δόση των 10 mg/kg δύο φορές την ημέρα (20 mg/kg/ημέρα) με βάση την κλινική ανταπόκριση και την ανεκτικότητα (42, 43). Υπάρχουν δημοσιευμένα δεδομένα που υποδηλώνουν ότι η δόση μπορεί να αυξηθεί έως και 50 mg/kg/ημέρα εάν είναι ανεκτή και παρατηρηθεί κλινική ανταπόκριση (22, 23, 44).
Ωστόσο, για ασθενείς με το ίδιο επίπεδο CBD στο πλάσμα, οι διαφορές στη βελτίωση των κρίσεων δεν εξαρτώνται από την ηλικία. Έτσι, τα επίπεδα στο πλάσμα μπορεί να είναι μια στρατηγική για την καθοδήγηση των δόσεων CBD για ενήλικες ασθενείς με επιληψία. Αναλύσεις έχουν αναπτυχθεί και επικυρωθεί και μπορεί να είναι κλινικά χρήσιμες στο μέλλον (32, 45, 46).
Ανοχή μπορεί να εμφανιστεί έως και στο ένα τρίτο των ασθενών με CBD. Μπορεί να οριστεί είτε ως η αναγκαιότητα αύξησης της δόσης κατά τουλάχιστον 30% είτε ως μείωση της ανταπόκρισης μεγαλύτερη από 30%. Ο μέσος χρόνος μέχρι την εμφάνιση της ανοχής βρέθηκε να είναι 7 μήνες. Οι μακροπρόθεσμοι κίνδυνοι και η αποτελεσματικότητα της χρήσης CBD είναι άγνωστες (47).
Συμπέρασμα
Η CBD είναι μια αποτελεσματική θεραπεία για ασθενείς με σύνδρομα Dravet και Lennox-Gastaut. Η χρήση ινδικής κάνναβης και άλλων προϊόντων πλούσιων σε THC δεν ενδείκνυται λόγω της αμφίβολης επίδρασής της στον έλεγχο των επιληπτικών κρίσεων και των αρνητικών ψυχοτρόπων επιδράσεων (12).
Ο ρόλος της CBD στη θεραπεία της ανθεκτικής στα φάρμακα επιληψίας είναι επικουρικός και συχνά υπερεκτιμάται. Οι ανεπιθύμητες ενέργειες είναι συνήθως ήπιες και το ποσοστό διακοπής είναι χαμηλό. Η εργαστηριακή παρακολούθηση θα πρέπει να εστιάζεται στην ηπατοτοξικότητα και στην παρακολούθηση των θεραπευτικών φαρμάκων των ταυτόχρονων ASMs, ιδιαίτερα του CLB.
Τα θέματα για μελλοντική έρευνα θα πρέπει να περιλαμβάνουν (α) την αποτελεσματικότητα και τη βέλτιστη δόση της CBD για ενήλικες ασθενείς με επιληψία, ιδιαίτερα την εστιακή επιληψία. (β) μακροπρόθεσμες ψυχιατρικές και γνωστικές δυσμενείς επιπτώσεις που σχετίζονται με την CBD· και (γ) στρατηγικές για τη μείωση του κόστους και τη βελτίωση της πρόσβασης σε CBD για άτομα που ζουν με επιληψία (50).
Πηγές:
1. Chen Z, Brodie MJ, Liew D, Kwan P. Treatment outcomes in patients with newly diagnosed epilepsy treated with established and new antiepileptic drugs:a 30-year longitudinal cohort study. JAMA Neurol. (2018) 75:279–86. doi: 10.1001/jamaneurol.2017.3949
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Ryvlin P, Cross JH, Rheims S. Epilepsy surgery in children and adults. Lancet Neurol. (2014) 13:1114–26. doi: 10.1016/S1474-4422(14)70156-5
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Friedman D, Devinsky O. Cannabinoids in the treatment of epilepsy. N Engl J Med. (2015) 373:1048–58. doi: 10.1056/NEJMra1407304
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Devane WA, Hanus L, Breuer A, Pertwee RG, Stevenson LA, Griffin G, et al. Isolation and structure of a brain constituent that binds to the cannabinoid receptor. Science. (1992) 258:1946–9. doi: 10.1126/science.1470919
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Maa E, Figi P. The case for medical marijuana in epilepsy. Epilepsia. (2014) 55:783–6. doi: 10.1111/epi.12610
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Gloss D, Vickrey B. Cannabinoids for epilepsy. Cochrane Database Syst Rev. (2014) 3:CD009270. doi: 10.1002/14651858.CD009270.pub3
CrossRef Full Text | Google Scholar
7. Koppel BS, Brust JCM, Fife T, Bronstein J, Youssof S, Gronseth G, et al. Systematic review:efficacy and safety of medical marijuana in selected neurologic disorders:report of the guideline development subcommittee of the american academy of neurology. Neurology. (2014) 82:1556–63. doi: 10.1212/WNL.0000000000000363
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Mechoulam R, Carlini EA. Toward drugs derived from cannabis. Naturwissenschaften. (1978) 65:174–9. doi: 10.1007/BF00450585
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Cunha JM, Carlini EA, Pereira AE, Ramos OL, Pimentel C, Gagliardi R, et al. Chronic administration of cannabidiol to healthy volunteers and epileptic patients. Pharmacology. (1980) 21:175–85. doi: 10.1159/000137430
CrossRef Full Text | Google Scholar
10. Ames FR, Cridland S. Anticonvulsant effect of cannabidiol. S Afr Med J. (1986) 69:14.
11. Trembly B, Sherman M. Double-blind clinical study of cannabidiol as a secondary anticonvulsant. In: Marijuana ’90 International Conference on Cannabis and Cannabinoids. Kolympari (1990).
12. Pinto LF. Análise crítica 1do papel do canabidiol no tratamento da epilepsia. In: Jorge CL, Yacubian EM, Valente KD, Pinto LF, Sampaio LPB, Manreza MLG, editors. Epilepsia atual 1edSão paulo 2018, Vol. 1. 1st ed. São Paulo: Omni Farma Ltda (2018). p. 89–110.
13. Fish BS, Consroe P, Fox RR. Inheritance of delta 9-tetrahydrocannabinol seizure susceptibility in rabbits. J Hered. (1981) 72:215–6. doi: 10.1093/oxfordjournals.jhered.a109475
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Turkanis SA, Karler R. Central excitatory properties of delta 9-tetrahydrocannabinol and its metabolites in iron-induced epileptic rats. Neuropharmacology. (1982) 21:7–13. doi: 10.1016/0028-3908(82)90204-0
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Johnson DD, McNeill JR, Crawford RD, Wilcox WC. Epileptiform seizures in domestic fowl. V. The anticonvulsant activity of delta9-tetrahydrocannabinol. Can J Physiol Pharmacol. (1975) 53:1007–13. doi: 10.1139/y75-140
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Wada JA, Wake A, Sato M, Corcoran ME. Antiepileptic and prophylactic effects of tetrahydrocannabinols in amygdaloid kindled cats. Epilepsia. (1975) 16:503–10. doi: 10.1111/j.1528-1157.1975.tb06080.x
PubMed Abstract | CrossRef Full Text | Google Scholar
17. Consroe P, Benedito MA, Leite JR, Carlini EA, Mechoulam R. Effects of cannabidiol on behavioral seizures caused by convulsant drugs or current in mice. Eur J Pharmacol. (1982) 83:293–8. doi: 10.1016/0014-2999(82)90264-3
CrossRef Full Text | Google Scholar
18. Consroe P, Martin A, Singh V. Antiepileptic potential of cannabidiol analogs. J Clin Pharmacol. (1981) 21:428S−36S. doi: 10.1002/j.1552-4604.1981.tb02623.x
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Pertwee RG. The diverse CB1 and CB2 receptor pharmacology of three plant cannabinoids:delta9-tetrahydrocannabinol, cannabidiol and delta9-tetrahydrocannabivarin. Br J Pharmacol. (2008) 153:199–215. doi: 10.1038/sj.bjp.0707442
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Perucca E. Cannabinoids in the treatment of epilepsy: hard evidence at Last? J Epilepsy Res. (2017) 7:61–76. doi: 10.14581/jer.17012
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Jones NA, Glyn SE, Akiyama S, Hill TDM, Hill AJ, Weston SE, et al. Cannabidiol exerts anti-convulsant effects in animal models of temporal lobe and partial seizures. Seizure. (2012) 21:344–52. doi: 10.1016/j.seizure.2012.03.001
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Devinsky O, Marsh E, Friedman D, Thiele E, Laux L, Sullivan J, et al. Cannabidiol in patients with treatment-resistant epilepsy:an open-label interventional trial. Lancet Neurol. (2016) 15:270–8. doi: 10.1016/S1474-4422(15)00379-8
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Hess EJ, Moody KA, Geffrey AL, Pollack SF, Skirvin LA, Bruno PL, et al. Cannabidiol as a new treatment for drug-resistant epilepsy in tuberous sclerosis complex. Epilepsia. (2016) 57:1617–24. doi: 10.1111/epi.13499
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Devinsky O, Cross JH, Laux L, Marsh E, Miller I, Nabbout R, et al. Trial of cannabidiol for drug-resistant seizures in the dravet syndrome. N Engl J Med. (2017) 376:2011–20. doi: 10.1056/NEJMoa1611618
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Devinsky O, Patel AD, Cross JH, Villanueva V, Wirrell EC, Privitera M, et al. Effect of cannabidiol on drop seizures in the lennox-gastaut syndrome. N Engl J Med. (2018) 378:1888–97. doi: 10.1056/NEJMoa1714631
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Thiele EA, Marsh ED, French JA, Mazurkiewicz-Beldzinska M, Benbadis SR, Joshi C, et al. Cannabidiol in patients with seizures associated with lennox-gastaut syndrome (GWPCARE4):a randomised, double-blind, placebo-controlled phase 3 trial. Lancet. (2018) 391:1085–96. doi: 10.1016/S0140-6736(18)30136-3
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Stockings E, Zagic D, Campbell G, Weier M, Hall WD, Nielsen S, et al. Evidence for cannabis and cannabinoids for epilepsy:a systematic review of controlled and observational evidence. J Neurol Neurosur Psychiatr. (2018) 89:741–53. doi: 10.1136/jnnp-2017-317168
CrossRef Full Text | Google Scholar
28. Lattanzi S, Trinka E, Striano P, Zaccara G, Del Giovane C, Nardone R, et al. Cannabidiol efficacy and clobazam status:a systematic review and meta-analysis. Epilepsia. (2020) 61:1090–8. doi: 10.1111/epi.16546
PubMed Abstract | CrossRef Full Text | Google Scholar
29. Anderson LL, Absalom NL, Abelev SV, Low IK, Doohan PT, Martin LJ, et al. Coadministered cannabidiol and clobazam:preclinical evidence for both pharmacodynamic and pharmacokinetic interactions. Epilepsia. (2019) 60:2224–34. doi: 10.1111/epi.16355
PubMed Abstract | CrossRef Full Text | Google Scholar
30. Thiele E, Marsh E, Mazurkiewicz-Beldzinska M, Halford JJ, Gunning B, Devinsky O, et al. Cannabidiol in patients with Lennox-Gastaut syndrome: Interim analysis of an open-label extension study. Epilepsia. (2019) 60:419–28. doi: 10.1111/epi.14670
CrossRef Full Text | Google Scholar
31. Devinsky O, Nabbout R, Miller I, Laux L, Zolnowska M, Wright S, et al. Long-term cannabidiol treatment in patients with Dravet syndrome: An open-label extension trial. Epilepsia. (2019) 60:294–302. doi: 10.1111/epi.14628
CrossRef Full Text | Google Scholar
32. Szaflarski JP, Hernando K, Bebin EM, Gaston TE, Grayson LE, Ampah SB, et al. Higher cannabidiol plasma levels are associated with better seizure response following treatment with a pharmaceutical grade cannabidiol. Epilepsy Behav. (2019) 95:131–6. doi: 10.1016/j.yebeh.2019.03.042
PubMed Abstract | CrossRef Full Text | Google Scholar
33. Di Forti M, Quattrone D, Freeman TP, Tripoli G, Gayer-Anderson C, Quigley H, et al. The contribution of cannabis use to variation in the incidence of psychotic disorder across europe (EU-GEI):a multicentre case-control study. Lancet Psychiatry. (2019) 6:427–36. doi: 10.1016/S2215-0366(19)30048-3
PubMed Abstract | CrossRef Full Text | Google Scholar
34. Devinsky O, Sullivan J, Friedman D, Thiele E, Marsh E, Laux L, et al. Epidiolex (cannabidiol) in treatment resistant epilepsy. In: Conference: 67th Annual Meeting of the American-Academy-of-Neurology (AAN). Washington, DC (2015).
35. Birnbaum AK, Karanam A, Marino SE, Barkley CM, Remmel RP, Roslawski M, et al. Food effect on pharmacokinetics of cannabidiol oral capsules in adult patients with refractory epilepsy. Epilepsia. (2019) 60:1586–92. doi: 10.1111/epi.16093
PubMed Abstract | CrossRef Full Text | Google Scholar
36. Stout SM, Cimino NM. Exogenous cannabinoids as substrates, inhibitors, and inducers of human drug metabolizing enzymes:a systematic review. Drug Metab Rev. (2014) 46:86–95. doi: 10.3109/03602532.2013.849268
PubMed Abstract | CrossRef Full Text | Google Scholar
37. Geffrey AL, Pollack SF, Bruno PL, Thiele EA. Drug-drug interaction between clobazam and cannabidiol in children with refractory epilepsy. Epilepsia. (2015) 56:1246–51. doi: 10.1111/epi.13060
PubMed Abstract | CrossRef Full Text | Google Scholar
38. Gaston TE, Bebin EM, Cutter GR, Liu Y, Szaflarski JP. UAB CBD Program. Interactions between cannabidiol and commonly used antiepileptic drugs. Epilepsia. (2017) 58:1586–92. doi: 10.1111/epi.13852
PubMed Abstract | CrossRef Full Text | Google Scholar
39. Devinsky O, Patel AD, Thiele EA, Wong MH, Appleton R, Harden CL, et al. Randomized, dose-ranging safety trial of cannabidiol in dravet syndrome. Neurology. (2018) 90:e1204–11. doi: 10.1212/WNL.0000000000005254
PubMed Abstract | CrossRef Full Text | Google Scholar
40. Nugent SM, Morasco BJ, O’Neil ME, Freeman M, Low A, Kondo K, et al. The effects of cannabis among adults with chronic pain and an overview of general harms:a systematic review. Ann Intern Med. (2017) 167:319–31. doi: 10.7326/M17-0155
CrossRef Full Text | Google Scholar
41. Fergusson DM, Horwood LJ, Northstone K, ALSPAC Study Team. Avon longitudinal study of pregnancy and childhood. maternal use of cannabis and pregnancy outcome. BJOG. (2002) 109:21–7. doi: 10.1111/j.1471-0528.2002.01020.x
PubMed Abstract | CrossRef Full Text | Google Scholar
42. Available online at: https://www.accessdata.fda.gov/drugsatfda_docs/label/2018/210365lbl.pdf (accessed August 6, 2020).
43. Available online at: https://www.ema.europa.eu/en/documents/product-information/epidyolex-epar-product-information_en.pdf (accessed August 6, 2020).
44. Millar SA, Stone NL, Bellman ZD, Yates AS, England TJ, O’Sullivan SE. A systematic review of cannabidiol dosing in clinical populations. Br J Clin Pharmacol. (2019) 85:1888–900. doi: 10.1111/bcp.14038
PubMed Abstract | CrossRef Full Text | Google Scholar
45. Barco S, Fucile C, Manfredini L, De Grandis E, Gherzi M, Martelli A, et al. A UHPLC-MS/MS method for the quantification of Δ9-tetrahydrocannabinol and cannabidiol in decoctions and in plasma samples for therapeutic monitoring of medical cannabis. Bioanalysis. (2018) 10:2003–14. doi: 10.4155/bio-2018-0184
CrossRef Full Text | Google Scholar
46. Ocque AJ, Hagler CE, DiFrancesco R, Lombardo J, Morse GD. Development and validation of an assay to measure cannabidiol and Δ9-tetrahydrocannabinol in human EDTA plasma by UHPLC-MS/MS. J Chromatogr B Analyt Technol Biomed Life Sci. (2019) 1112:56–60. doi: 10.1016/j.jchromb.2019.03.002
PubMed Abstract | CrossRef Full Text | Google Scholar
47. Uliel-Sibony S, Hausman-Kedem M, Kramer U. Cannabidiol Tolerance in Children and Adults With Treatment-Resistant Epilepsy. New Orleans, LA: American Epilepsy Society (AES) (2018)
PubMed Abstract | Google Scholar
48. Vandrey R, Raber JC, Raber ME, Douglass B, Miller C, Bonn-Miller MO. Cannabinoid dose and label accuracy in edible medical cannabis products. JAMA. (2015) 313:2491–3. doi: 10.1001/jama.2015.6613
PubMed Abstract | CrossRef Full Text | Google Scholar
49. Suraev A, Lintzeris N, Stuart J, Kevin RC, Blackburn R, Richards E, et al. Composition and use of cannabis extracts for childhood epilepsy in the australian community. Sci Rep. (2018) 8:10154. doi: 10.1038/s41598-018-30164-8
CrossRef Full Text | Google Scholar
50. Klotz KA, Grob D, Hirsch M, Metternich B, Schulze-Bonhage A, Jacobs J. Efficacy and tolerance of synthetic cannabidiol for treatment of drug resistant epilepsy. Front Neurol. (2019) 10:1313. doi: 10.3389/fneur.2019.01313